Introduzione:
L’emofilia è un difetto genetico della coagulazione con trasmissione di tipo X-linked causato della carenza del fattore VIII della coagulazione (emofilia A) o del fattore IX (emofilia B) [1]. La prevalenza è 1/5000 per l’emofilia A e 1/30000 per l’emofilia B [1]. Gli individui affetti presentano manifestazioni emorragiche e le emorragie articolari (emartri) rappresentano oltre l’80% degli episodi emorragici riportati dai pazienti con emofilia [2]. Sebbene tutte le articolazioni possano essere potenzialmente interessate dagli emartri, di solito sono coinvolte le grandi articolazioni sinoviali (gomiti, ginocchia e caviglie) [2]. Il susseguirsi degli emartri determina un progressivo sviluppo di un’artropatia caratterizzata da alterazioni severe ed invalidanti [2].
Sebbene, sia ben noto che i pazienti con emofilia A grave (FVIII attività <1%) mostrino un fenotipo emorragico più severo, diverse evidenze della letteratura mostrano che anche i pazienti con emofilia A di grado moderato (FVIII attività 2-5%) hanno un’incidenza significativa di sanguinamenti articolari e, quindi, una probabilità non trascurabile di sviluppare artropatia [3].
Nonostante, l’utilizzo crescente della profilassi con fattore FVIII abbia drammaticamente ridotto il numero di emartri, ancora il 25-30% dei soggetti riporta segni clinici dell’artropatia emofilica (AE). Quindi, l’artropatia rappresenta ancora la principale complicanza cronica dell’emofilia [3].
In precedenza, dati provenienti da diversi studi descrivevano l'artropatia emofilica come un’alterazione di tipo degenerativo, con tratti simili a quelli dell’osteoartrite (OA) [4,5]. Tuttavia, evidenze più recenti hanno dimostrato come nella fisiopatologia dell'artropatia emofilica siano coinvolti anche complessi meccanismi infiammatori e immunologici [5].
Con l'obiettivo di identificare precocemente le alterazioni a livello articolare e al fine di prevenire lo sviluppo e la progressione dell’artropatia emofilica, il monitoraggio periodico dello stato articolare nei pazienti affetti da emofilia è stato raccomandato nell'ambito di un approccio multidisciplinare alla cura dell’emofilia [6,7]. La valutazione dello stato articolare diventa quindi un momento fondamentale nel follow-up clinico del paziente con emofila.
Fisiopatologia dell’artropatia emofilica:
Quando si verifica un emartro, la deposizione di ferro derivato dal sangue (emosiderina) determina un danno “chimico” al tessuto sinoviale che porta all'attivazione di processi infiammatori ed anti-apoptotici [5]. In uno studio condotto su modelli murini di emartro è stato dimostrato un danno chimico indotto dal ferro, sottolineando anche il ruolo patogeno dei metaboliti derivati dal ferro (Ferroportina; Epcidina; Recettore scavenger per l’emoglobina (CD163); proteine trasportatrici dell’eme) [8].
Questi dati sono stati confermati in uno studio che confronta sezioni istologiche sinoviali di pazienti affetti da artrite reumatoide (AR), OA ed artropatia emofilica. L'espressione nucleare e citoplasmatica dei metaboliti derivati dal ferro era molto più abbondante nel tessuto sinoviale dei pazienti emofilici rispetto a OA e AR, suggerendo così un ruolo cruciale nella fisiopatologia dell'artropatia emofilica [8]. In particolare, la deposizione di emosiderina all'interno dei sinoviociti e la presenza di metaboliti del ferro, sono associati alla produzione di specie reattive dell'ossigeno (ROS) tramite la reazione di Haber–Weiss/Fenton (Fe2+ + H2O2 → Fe3+ + OH− + OH−) [5].
Come conseguenza, la sottile membrana sinoviale diventa una membrana ipertrofica e villosa, attraverso l'induzione della sintesi del DNA e della proliferazione cellulare. Infatti, l'emosiderina inibisce l'apoptosi delle cellule sinoviali stimolando l'amplificazione dell'oncogene virale mielocitomatosi (c-MYC) (un proto-oncogene associato alla proliferazione cellulare) e MDM2 (una proteina che prende di mira il gene oncosoppressore p53) [4].
Questi risultati sono confermati dai risultati dello studio di Wen et al. che mostrano come il ferro sia coinvolto nella modulazione dell'espressione dell'omologo c-MYC e MDM2, portando alla proliferazione della sinovia [9].
A sua volta, la sinovia ipertrofica produce enzimi litici che inducono l'apoptosi dei condrociti e la riduzione dei proteoglicani. In accordo con questi meccanismi fisiopatologici, un recente studio condotto su modelli murini di emofilia, in cui gli emartri sono stati indotti artificialmente, ha mostrato che le manifestazioni degenerative dell’AE compaiono rapidamente dopo l'esposizione a prodotti di derivazione ematica. Infatti, la valutazione della sezione istologica ha evidenziato che la sinovite si è sviluppata entro 24 ore, mentre il danno cartilagineo e osseo si sono manifestati entro 48-96 ore. Ciò potrebbe suggerire un'influenza diretta del sangue in questi processi aldilà dell’effetto mediato dai processi infiammatori e immuno-mediati [10].
Nel complesso, i danni precoci secondari al danno chimico mediato dal ferro potrebbero rappresentare il primo passo nella patogenesi dell'artropatia emofilica [11].
Parallelamente, il ferro svolge un ruolo cruciale nell'induzione dell'espressione di diverse citochine pro-infiammatorie, tra cui l'interleuchina 1 beta (IL-1β), il fattore di necrosi tumorale alfa (TNFα) e l'interleuchina 6 (IL-6) [12].
In dettaglio, i sinoviociti di tipo A, dopo aver incorporato il ferro, producono citochine infiammatorie (IL-1β, IL-6, TNFα), inducendo a loro volta la migrazione delle cellule polimorfonucleate e, successivamente, dei monociti e dei linfociti. Ciò porta a un ciclo di auto-mantenimento che aumenta ulteriormente la risposta infiammatoria e induce un processo pro-angiogenetico [4]. Infatti, la sinovia infiammata e ipertrofica ha una maggiore richiesta di ossigeno, stimolando sia a livello locale che sistemico il rilascio di fattori di crescita come il fattore di crescita endoteliale di derivazione vascolare (VEGF), promuovendo così la neo-angiogenesi [5].
Questi fenomeni che coinvolgono il tessuto sinoviale possono indurre un processo infiammatorio cronico mediato da citochine e molecole pro-angiogeniche, commutando il processo da danno chimico a danno infiammatorio caratterizzato da progressiva crescita del panno sinoviale e peggioramento del danno cartilagineo articolare [4,13].
Pertanto, la membrana sinoviale e le cellule endoteliali sinoviali diventano un serbatoio attivo di cellule e di mediatori infiammatori e propagano la risposta infiammatoria [5].
Valutazione clinica e strumentale dell’artropatia emofilica
La valutazione clinica dello stato articolare nel paziente con emofilia rappresenta un momento fondamentale per il follow-up. La valutazione articolare può essere effettuata con l’esame clinico e l’utilizzo di sistemi di score (ad es. Gilbert Orthopaedic Joint Score; WFH; Hemophilia Joint Health Score (HJHS)), oppure attraverso metodiche di diagnostica per immagini.
Considerando che la sensibilità e specificità degli score di valutazione clinica, effettuati attraverso l’esecuzione dell'esame obiettivo articolare, risultano fortemente influenzate dalla difficoltà di esecuzione e mostrano delle carenze soprattutto nell'identificazione del danno articolare subclinico precoce è necessario integrare l’esame clinico con la diagnostica strumentale [14-16]. L’impiego della radiografia (RX) e della risonanza magnetica nucleare (RMN) è stato raccomandato come complemento all'esame clinico per valutare lo stato articolare e la conseguente progressione del danno nei pazienti con emofilia, ma tali tecniche non sono scevre di potenziali limiti diagnostici ed esecutivi.
Infatti, la radiografia è in grado di rilevare alterazioni artropatiche avanzate, ma ha scarso valore nel riconoscere i segni precoci della malattia [17,18].
Al contrario, la RMN può essere considerata altamente sensibile per rivelare segni di attività della malattia ed efficace per eseguire una valutazione completa delle superfici articolari. D’altro canto presenta diversi limiti: non permette di valutare più di un'articolazione in un singolo studio, il tempo di esame non può essere inferiore a 25-30 minuti per articolazione per ottenere informazioni accurate sullo stato delle superfici articolari, il posizionamento dell'articolazione nel magnete può essere difficile in caso di artropatia avanzata [19]. Inoltre, l'imaging tramite RMN può richiedere la sedazione nei pazienti pediatrici, è un esame costoso con lunghe liste di attesa, non può essere utilizzata per studi di follow-up seriali e, in assenza di versamento articolare, necessita di iniezione di contrasto intra-articolare per evidenziare i cambiamenti osteocondrali iniziali con precisione [19]. Sebbene spesso considerata la modalità di imaging di scelta per la valutazione muscolo-scheletrica, la RMN presenta dei limiti nella valutazione dell'artropatia emofilica e non può essere utilizzata come metodo di screening per la valutazione multi-articolare e ripetuti esami di follow-up [20,21].
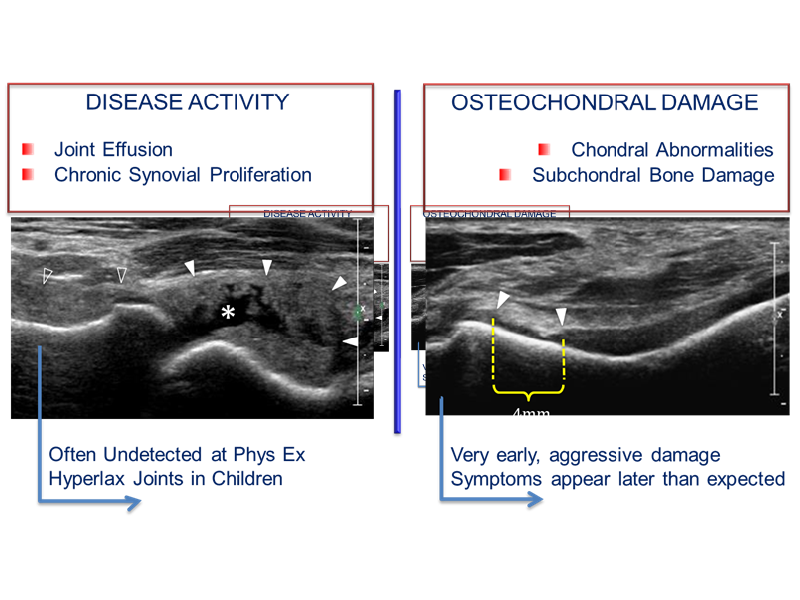
L'ecografia si è dimostrata in grado di rilevare e quantificare i marcatori dell'attività di malattia (es. versamento articolare e ipertrofia sinoviale) e dei danni degenerativi (es. alterazioni osteo-condrali) mediante scale di punteggio di gravità crescente della malattia [2].
Il ruolo dell’ecografia nella valutazione dell’artropatia emofilica
Negli ultimi anni è stato segnalato un crescente interesse verso gli ultrasuoni come strumento per la valutazione dello stato articolare e della progressione dell’artropatia emofilica [2]. Il primo studio in cui è stata valutata lo stato articolare nei pazienti emofilici con l’ecografia è stato eseguito da Wilson et al. nel 1987 su 38 pazienti con emartro acuto [22]. Successivamente, sono stati condotti diversi studi per definire il ruolo dell’ecografia articolare per diagnosticare episodi di sanguinamento acuto a livello di articolazioni e muscoli al fine di stabilire come rilevare la presenza sangue nella cavità articolare, misurarne la quantità e seguirne il riassorbimento fino alla completa scomparsa [2]. Alla luce dei risultati, l’ecografia si è dimostrata utile nel distinguere tra versamento infiammatorio (siero) ed ematico (emartro) e nel definire con precisione se gli episodi di dolore acuto nei pazienti affetti da emofilia sono effettivamente dovuti ad un emartro oppure a manifestazioni di tipo degenerativo a livello osteo-cartilagineo [23,24]. Oltre a discriminare la presenza dell’emartro sia nella sua forma clinicamente manifesta, sia nella forma sub-clinica, l'esame ecografico è in grado di rilevare e quantificare l'ipertrofia sinoviale, riconosciuta come il principale marcatore di attività di malattia articolare in emofilia. In aggiunta, attraverso l’esame ecografico si possono valutare le alterazioni di tipo degenerativo a livello osteocondrali e quantificare la gravità per mezzo di sistemi di scale con punteggio (Figura 1) [25,26]. Negli ultimi anni, sono stati proposti diversi protocolli dedicati per identificare e quantificare le anomalie articolari nei pazienti con emofilia attraverso l’ecografia. È interessante notare, che tutti questi sistemi riconoscono il ruolo del rilevamento della sinovite come principale indicatore di attività della malattia [27,28]. Alla luce di questo, alcune recenti linee guida del Regno Unito hanno definito il concetto di "articolazione a rischio" come un'articolazione con sinovite [29]. In aggiunta, un documento dell’Associazione Italiana dei Centri Emofilia (AICE) ha delineato le raccomandazioni per la diagnosi e la terapia dell’ipertrofia sinoviale nei pazienti emofilici con lo scopo di ottimizzare la personalizzazione della terapia. Da questo punto di vista, l'esame ecografico identificando facilmente la sinovite, guidare i medici nel processo decisionale del trattamento ottimale per i pazienti affetti da emofilia (Figura 1).
Conclusioni:
Nonostante l’uso crescente della profilassi abbia ridotto di molto l’incidenza di emartri, l’artropatia emofilica continua a rappresenta la principale complicanza cronica dell’emofilia. I meccanismi fisiopatologici alla base del suo sviluppo sono molteplici ed includono danno chimico, risposta infiammatoria e danno degenerativo. Le tecniche di diagnostica per immagini sono alla base della valutazione delle complicanze articolari nei pazienti emofilici. Tra le tecniche disponibili, l’ecografia si è rivelata uno strumento fondamentale sia per facilità di esecuzione ma anche per possibilità di valutare sia l’attività di malattia (emartro e sinovite) che il danno osteocondrale. Ciò permette al clinico di effettuare sempre più terapie e follow-up mirati tramite metodiche non invasiva, poco costosa e riproducibile.
Figura 1. Ecografia per la valutazione di alterazioni degenerative osteocondrali e segni di attività nei pazienti con emofilia
 Bibliografia
1. Acharya, S.S. Exploration of the pathogenesis of haemophilic joint arthropathy: understanding implications for optimal clinical management. Br J Haematol 2012, 156, 13-23, doi:10.1111/j.1365-2141.2011.08919.x.
2. Di Minno, M.N.; Ambrosino, P.; Quintavalle, G.; Coppola, A.; Tagliaferri, A.; Martinoli, C.; Rivolta, G.F. Assessment of Hemophilic Arthropathy by Ultrasound: Where Do We Stand? Semin Thromb Hemost 2016, 42, 541-549, doi:10.1055/s-0036-1579640.
3. Srivastava, A.; Santagostino, E.; Dougall, A.; Kitchen, S.; Sutherland, M.; Pipe, S.W.; Carcao, M.; Mahlangu, J.; Ragni, M.V.; Windyga, J., et al. WFH Guidelines for the Management of Hemophilia, 3rd edition. Haemophilia 2020, 26 Suppl 6, 1-158, doi:10.1111/hae.14046.
4. Pulles, A.E.; Mastbergen, S.C.; Schutgens, R.E.; Lafeber, F.P.; van Vulpen, L.F. Pathophysiology of hemophilic arthropathy and potential targets for therapy. Pharmacol Res 2017, 115, 192-199, doi:10.1016/j.phrs.2016.11.032.
5. Calcaterra, I.; Iannuzzo, G.; Dell'Aquila, F.; Di Minno, M.N.D. Pathophysiological Role of Synovitis in Hemophilic Arthropathy Development: A Two-Hit Hypothesis. Front Physiol 2020, 11, 541, doi:10.3389/fphys.2020.00541.
6. Colvin, B.T.; Astermark, J.; Fischer, K.; Gringeri, A.; Lassila, R.; Schramm, W.; Thomas, A.; Ingerslev, J.; Inter Disciplinary Working, G. European principles of haemophilia care. Haemophilia 2008, 14, 361-374, doi:10.1111/j.1365-2516.2007.01625.x.
7. Martinoli, C.; Della Casa Alberighi, O.; Di Minno, G.; Graziano, E.; Molinari, A.C.; Pasta, G.; Russo, G.; Santagostino, E.; Tagliaferri, A.; Tagliafico, A., et al. Development and definition of a simplified scanning procedure and scoring method for Haemophilia Early Arthropathy Detection with Ultrasound (HEAD-US). Thromb Haemost 2013, 109, 1170-1179, doi:10.1160/TH12-11-0874.
8. Nieuwenhuizen, L.; Schutgens, R.E.; van Asbeck, B.S.; Wenting, M.J.; van Veghel, K.; Roosendaal, G.; Biesma, D.H.; Lafeber, F.P. Identification and expression of iron regulators in human synovium: evidence for upregulation in haemophilic arthropathy compared to rheumatoid arthritis, osteoarthritis, and healthy controls. Haemophilia 2013, 19, e218-227, doi:10.1111/hae.12208.
9. Wen, F.Q.; Jabbar, A.A.; Chen, Y.X.; Kazarian, T.; Patel, D.A.; Valentino, L.A. c-myc proto-oncogene expression in hemophilic synovitis: in vitro studies of the effects of iron and ceramide. Blood 2002, 100, 912-916, doi:10.1182/blood-2002-02-0390.
10. Christensen, K.R.; Kjelgaard-Hansen, M.; Nielsen, L.N.; Wiinberg, B.; Alexander Althoehn, F.; Bloksgaard Poulsen, N.; Kryger Vols, K.; Popp Thyme, A.; Maria Lovgren, K.; Kornerup Hansen, A., et al. Rapid inflammation and early degeneration of bone and cartilage revealed in a time-course study of induced haemarthrosis in haemophilic rats. Rheumatology (Oxford) 2019, 58, 588-599, doi:10.1093/rheumatology/key186.
11. Roosendaal, G.; van Rinsum, A.C.; Vianen, M.E.; van den Berg, H.M.; Lafeber, F.P.; Bijlsma, J.W. Haemophilic arthropathy resembles degenerative rather than inflammatory joint disease. Histopathology 1999, 34, 144-153, doi:10.1046/j.1365-2559.1999.00608.x.
12. Melchiorre, D.; Manetti, M.; Matucci-Cerinic, M. Pathophysiology of Hemophilic Arthropathy. J Clin Med 2017, 6, doi:10.3390/jcm6070063.
13. Valentino, L.A. Blood-induced joint disease: the pathophysiology of hemophilic arthropathy. J Thromb Haemost 2010, 8, 1895-1902, doi:10.1111/j.1538-7836.2010.03962.x.
14. Pettersson, H.; Ahlberg, A.; Nilsson, I.M. A radiologic classification of hemophilic arthropathy. Clin Orthop Relat Res 1980, 153-159.
15. Feldman, B.M.; Funk, S.M.; Bergstrom, B.M.; Zourikian, N.; Hilliard, P.; van der Net, J.; Engelbert, R.; Petrini, P.; van den Berg, H.M.; Manco-Johnson, M.J., et al. Validation of a new pediatric joint scoring system from the International Hemophilia Prophylaxis Study Group: validity of the hemophilia joint health score. Arthritis Care Res (Hoboken) 2011, 63, 223-230, doi:10.1002/acr.20353.
16. Nijdam, A.; Bladen, M.; Hubert, N.; Pettersson, M.; Bartels, B.; van der Net, J.; Liesner, R.; Petrini, P.; Kurnik, K.; Fischer, K. Using routine Haemophilia Joint Health Score for international comparisons of haemophilia outcome: standardization is needed. Haemophilia 2016, 22, 142-147, doi:10.1111/hae.12755.
17. Cross, S.; Vaidya, S.; Fotiadis, N. Hemophilic arthropathy: a review of imaging and staging. Semin Ultrasound CT MR 2013, 34, 516-524, doi:10.1053/j.sult.2013.05.007.
18. Doria, A.S. State-of-the-art imaging techniques for the evaluation of haemophilic arthropathy: present and future. Haemophilia 2010, 16 Suppl 5, 107-114, doi:10.1111/j.1365-2516.2010.02307.x.
19. Funk, M.B.; Schmidt, H.; Becker, S.; Escuriola, C.; Klarmann, D.; Klingebiel, T.; Kreuz, W. Modified magnetic resonance imaging score compared with orthopaedic and radiological scores for the evaluation of haemophilic arthropathy. Haemophilia 2002, 8, 98-103, doi:10.1046/j.1365-2516.2002.00585.x.
20. Acharya, S.S.; Schloss, R.; Dyke, J.P.; Mintz, D.N.; Christos, P.; DiMichele, D.M.; Adler, R.S. Power Doppler sonography in the diagnosis of hemophilic synovitis--a promising tool. J Thromb Haemost 2008, 6, 2055-2061, doi:10.1111/j.1538-7836.2008.03160.x.
21. Keshava, S.N.; Gibikote, S.; Doria, A.S. Imaging evaluation of hemophilia: musculoskeletal approach. Semin Thromb Hemost 2015, 41, 880-893, doi:10.1055/s-0035-1564798.
22. Wilson, D.J.; McLardy-Smith, P.D.; Woodham, C.H.; MacLarnon, J.C. Diagnostic ultrasound in haemophilia. J Bone Joint Surg Br 1987, 69, 103-107, doi:10.1302/0301-620X.69B1.3546324.
23. Ceponis, A.; Wong-Sefidan, I.; Glass, C.S.; von Drygalski, A. Rapid musculoskeletal ultrasound for painful episodes in adult haemophilia patients. Haemophilia 2013, 19, 790-798, doi:10.1111/hae.12175.
24. Bianchi, S.; Martinoli, C.; Bianchi-Zamorani, M.; Valle, M. Ultrasound of the joints. Eur Radiol 2002, 12, 56-61, doi:10.1007/s00330-001-1162-8.
25. Martinoli, C.; Di Minno, M.N.; Pasta, G.; Tagliafico, A. Hemosiderin Detection With Ultrasound: Reality or Myth? AJR Am J Roentgenol 2016, 206, W30, doi:10.2214/AJR.15.14981.
26. Di Minno, M.N.D.; Pasta, G.; Airaldi, S.; Zaottini, F.; Storino, A.; Cimino, E.; Martinoli, C. Ultrasound for Early Detection of Joint Disease in Patients with Hemophilic Arthropathy. J Clin Med 2017, 6, doi:10.3390/jcm6080077.
27. Hermans, C.; Dolan, G.; Jennings, I.; Windyga, J.; Lobet, S.; Rodriguez-Merchan, E.C.; Di Minno, M.N.; Jimenez-Yuste, V.; O'Mahony, B. Managing Haemophilia for Life: 5th Haemophilia Global Summit. Eur J Haematol 2015, 95 Suppl 78, 1-25, doi:10.1111/ejh.12617.
28. Martinoli, C.; Di Minno, M.N.; Pasta, G.; Tagliafico, A. Point-of-care ultrasound in haemophilic arthropathy: will the HEAD-US system supplement or replace physical examination? Haemophilia 2016, 22, 20-21, doi:10.1111/hae.12840.
29. Hanley, J.; McKernan, A.; Creagh, M.D.; Classey, S.; McLaughlin, P.; Goddard, N.; Briggs, P.J.; Frostick, S.; Giangrande, P.; Wilde, J., et al. Guidelines for the management of acute joint bleeds and chronic synovitis in haemophilia: A United Kingdom Haemophilia Centre Doctors' Organisation (UKHCDO) guideline. Haemophilia 2017, 23, 511-520, doi:10.1111/hae.13201.
30. Di Minno MND, Napolitano M, Giuffrida AC, Baldacci E, Carulli C, Boccalandro E, Bruno C, Forneris E, Ricca I, Passeri W, Martinelli M, Rivolta GF, Solimeno LP, Martinoli C, Rocino A, Pasta G. Diagnosis and treatment of chronic synovitis in patients with haemophilia: consensus statements from the Italian Association of Haemophilia Centres. Br J Haematol. 2021 [in press]
Bibliografia
1. Acharya, S.S. Exploration of the pathogenesis of haemophilic joint arthropathy: understanding implications for optimal clinical management. Br J Haematol 2012, 156, 13-23, doi:10.1111/j.1365-2141.2011.08919.x.
2. Di Minno, M.N.; Ambrosino, P.; Quintavalle, G.; Coppola, A.; Tagliaferri, A.; Martinoli, C.; Rivolta, G.F. Assessment of Hemophilic Arthropathy by Ultrasound: Where Do We Stand? Semin Thromb Hemost 2016, 42, 541-549, doi:10.1055/s-0036-1579640.
3. Srivastava, A.; Santagostino, E.; Dougall, A.; Kitchen, S.; Sutherland, M.; Pipe, S.W.; Carcao, M.; Mahlangu, J.; Ragni, M.V.; Windyga, J., et al. WFH Guidelines for the Management of Hemophilia, 3rd edition. Haemophilia 2020, 26 Suppl 6, 1-158, doi:10.1111/hae.14046.
4. Pulles, A.E.; Mastbergen, S.C.; Schutgens, R.E.; Lafeber, F.P.; van Vulpen, L.F. Pathophysiology of hemophilic arthropathy and potential targets for therapy. Pharmacol Res 2017, 115, 192-199, doi:10.1016/j.phrs.2016.11.032.
5. Calcaterra, I.; Iannuzzo, G.; Dell'Aquila, F.; Di Minno, M.N.D. Pathophysiological Role of Synovitis in Hemophilic Arthropathy Development: A Two-Hit Hypothesis. Front Physiol 2020, 11, 541, doi:10.3389/fphys.2020.00541.
6. Colvin, B.T.; Astermark, J.; Fischer, K.; Gringeri, A.; Lassila, R.; Schramm, W.; Thomas, A.; Ingerslev, J.; Inter Disciplinary Working, G. European principles of haemophilia care. Haemophilia 2008, 14, 361-374, doi:10.1111/j.1365-2516.2007.01625.x.
7. Martinoli, C.; Della Casa Alberighi, O.; Di Minno, G.; Graziano, E.; Molinari, A.C.; Pasta, G.; Russo, G.; Santagostino, E.; Tagliaferri, A.; Tagliafico, A., et al. Development and definition of a simplified scanning procedure and scoring method for Haemophilia Early Arthropathy Detection with Ultrasound (HEAD-US). Thromb Haemost 2013, 109, 1170-1179, doi:10.1160/TH12-11-0874.
8. Nieuwenhuizen, L.; Schutgens, R.E.; van Asbeck, B.S.; Wenting, M.J.; van Veghel, K.; Roosendaal, G.; Biesma, D.H.; Lafeber, F.P. Identification and expression of iron regulators in human synovium: evidence for upregulation in haemophilic arthropathy compared to rheumatoid arthritis, osteoarthritis, and healthy controls. Haemophilia 2013, 19, e218-227, doi:10.1111/hae.12208.
9. Wen, F.Q.; Jabbar, A.A.; Chen, Y.X.; Kazarian, T.; Patel, D.A.; Valentino, L.A. c-myc proto-oncogene expression in hemophilic synovitis: in vitro studies of the effects of iron and ceramide. Blood 2002, 100, 912-916, doi:10.1182/blood-2002-02-0390.
10. Christensen, K.R.; Kjelgaard-Hansen, M.; Nielsen, L.N.; Wiinberg, B.; Alexander Althoehn, F.; Bloksgaard Poulsen, N.; Kryger Vols, K.; Popp Thyme, A.; Maria Lovgren, K.; Kornerup Hansen, A., et al. Rapid inflammation and early degeneration of bone and cartilage revealed in a time-course study of induced haemarthrosis in haemophilic rats. Rheumatology (Oxford) 2019, 58, 588-599, doi:10.1093/rheumatology/key186.
11. Roosendaal, G.; van Rinsum, A.C.; Vianen, M.E.; van den Berg, H.M.; Lafeber, F.P.; Bijlsma, J.W. Haemophilic arthropathy resembles degenerative rather than inflammatory joint disease. Histopathology 1999, 34, 144-153, doi:10.1046/j.1365-2559.1999.00608.x.
12. Melchiorre, D.; Manetti, M.; Matucci-Cerinic, M. Pathophysiology of Hemophilic Arthropathy. J Clin Med 2017, 6, doi:10.3390/jcm6070063.
13. Valentino, L.A. Blood-induced joint disease: the pathophysiology of hemophilic arthropathy. J Thromb Haemost 2010, 8, 1895-1902, doi:10.1111/j.1538-7836.2010.03962.x.
14. Pettersson, H.; Ahlberg, A.; Nilsson, I.M. A radiologic classification of hemophilic arthropathy. Clin Orthop Relat Res 1980, 153-159.
15. Feldman, B.M.; Funk, S.M.; Bergstrom, B.M.; Zourikian, N.; Hilliard, P.; van der Net, J.; Engelbert, R.; Petrini, P.; van den Berg, H.M.; Manco-Johnson, M.J., et al. Validation of a new pediatric joint scoring system from the International Hemophilia Prophylaxis Study Group: validity of the hemophilia joint health score. Arthritis Care Res (Hoboken) 2011, 63, 223-230, doi:10.1002/acr.20353.
16. Nijdam, A.; Bladen, M.; Hubert, N.; Pettersson, M.; Bartels, B.; van der Net, J.; Liesner, R.; Petrini, P.; Kurnik, K.; Fischer, K. Using routine Haemophilia Joint Health Score for international comparisons of haemophilia outcome: standardization is needed. Haemophilia 2016, 22, 142-147, doi:10.1111/hae.12755.
17. Cross, S.; Vaidya, S.; Fotiadis, N. Hemophilic arthropathy: a review of imaging and staging. Semin Ultrasound CT MR 2013, 34, 516-524, doi:10.1053/j.sult.2013.05.007.
18. Doria, A.S. State-of-the-art imaging techniques for the evaluation of haemophilic arthropathy: present and future. Haemophilia 2010, 16 Suppl 5, 107-114, doi:10.1111/j.1365-2516.2010.02307.x.
19. Funk, M.B.; Schmidt, H.; Becker, S.; Escuriola, C.; Klarmann, D.; Klingebiel, T.; Kreuz, W. Modified magnetic resonance imaging score compared with orthopaedic and radiological scores for the evaluation of haemophilic arthropathy. Haemophilia 2002, 8, 98-103, doi:10.1046/j.1365-2516.2002.00585.x.
20. Acharya, S.S.; Schloss, R.; Dyke, J.P.; Mintz, D.N.; Christos, P.; DiMichele, D.M.; Adler, R.S. Power Doppler sonography in the diagnosis of hemophilic synovitis--a promising tool. J Thromb Haemost 2008, 6, 2055-2061, doi:10.1111/j.1538-7836.2008.03160.x.
21. Keshava, S.N.; Gibikote, S.; Doria, A.S. Imaging evaluation of hemophilia: musculoskeletal approach. Semin Thromb Hemost 2015, 41, 880-893, doi:10.1055/s-0035-1564798.
22. Wilson, D.J.; McLardy-Smith, P.D.; Woodham, C.H.; MacLarnon, J.C. Diagnostic ultrasound in haemophilia. J Bone Joint Surg Br 1987, 69, 103-107, doi:10.1302/0301-620X.69B1.3546324.
23. Ceponis, A.; Wong-Sefidan, I.; Glass, C.S.; von Drygalski, A. Rapid musculoskeletal ultrasound for painful episodes in adult haemophilia patients. Haemophilia 2013, 19, 790-798, doi:10.1111/hae.12175.
24. Bianchi, S.; Martinoli, C.; Bianchi-Zamorani, M.; Valle, M. Ultrasound of the joints. Eur Radiol 2002, 12, 56-61, doi:10.1007/s00330-001-1162-8.
25. Martinoli, C.; Di Minno, M.N.; Pasta, G.; Tagliafico, A. Hemosiderin Detection With Ultrasound: Reality or Myth? AJR Am J Roentgenol 2016, 206, W30, doi:10.2214/AJR.15.14981.
26. Di Minno, M.N.D.; Pasta, G.; Airaldi, S.; Zaottini, F.; Storino, A.; Cimino, E.; Martinoli, C. Ultrasound for Early Detection of Joint Disease in Patients with Hemophilic Arthropathy. J Clin Med 2017, 6, doi:10.3390/jcm6080077.
27. Hermans, C.; Dolan, G.; Jennings, I.; Windyga, J.; Lobet, S.; Rodriguez-Merchan, E.C.; Di Minno, M.N.; Jimenez-Yuste, V.; O'Mahony, B. Managing Haemophilia for Life: 5th Haemophilia Global Summit. Eur J Haematol 2015, 95 Suppl 78, 1-25, doi:10.1111/ejh.12617.
28. Martinoli, C.; Di Minno, M.N.; Pasta, G.; Tagliafico, A. Point-of-care ultrasound in haemophilic arthropathy: will the HEAD-US system supplement or replace physical examination? Haemophilia 2016, 22, 20-21, doi:10.1111/hae.12840.
29. Hanley, J.; McKernan, A.; Creagh, M.D.; Classey, S.; McLaughlin, P.; Goddard, N.; Briggs, P.J.; Frostick, S.; Giangrande, P.; Wilde, J., et al. Guidelines for the management of acute joint bleeds and chronic synovitis in haemophilia: A United Kingdom Haemophilia Centre Doctors' Organisation (UKHCDO) guideline. Haemophilia 2017, 23, 511-520, doi:10.1111/hae.13201.
30. Di Minno MND, Napolitano M, Giuffrida AC, Baldacci E, Carulli C, Boccalandro E, Bruno C, Forneris E, Ricca I, Passeri W, Martinelli M, Rivolta GF, Solimeno LP, Martinoli C, Rocino A, Pasta G. Diagnosis and treatment of chronic synovitis in patients with haemophilia: consensus statements from the Italian Association of Haemophilia Centres. Br J Haematol. 2021 [in press]






